Storia della luce: dai corpuscoli alle onde ai quanti
Dentro la materia: un veloce tour nell'atomo
Per comprendere il comportamento della luce, la prima cosa da fare è capire, in modo molto semplice, come funziona un atomo.
Da millenni, l'umanità alza gli occhi al cielo, interrogando quei piccoli e deboli punti luminosi. Da quelle semplici osservazioni, abbiamo costruito e confermato teorie rivoluzionarie, una testimonianza incredibile del nostro ingegno. Quelle luci sono ancora oggi l'oggetto di studio dell'astronomia, una delle scienze più affascinanti. La protagonista assoluta di questa indagine cosmica è la luce. Per comprendere i messaggi che ci porta dall'universo, dobbiamo prima capire la sua natura e come "dialoga" con la materia che incontra nel suo viaggio.
I mattoni dell'Universo: dentro l'atomo
Tutto ciò che ci circonda, dalle stelle più remote a noi stessi, è composto da atomi.
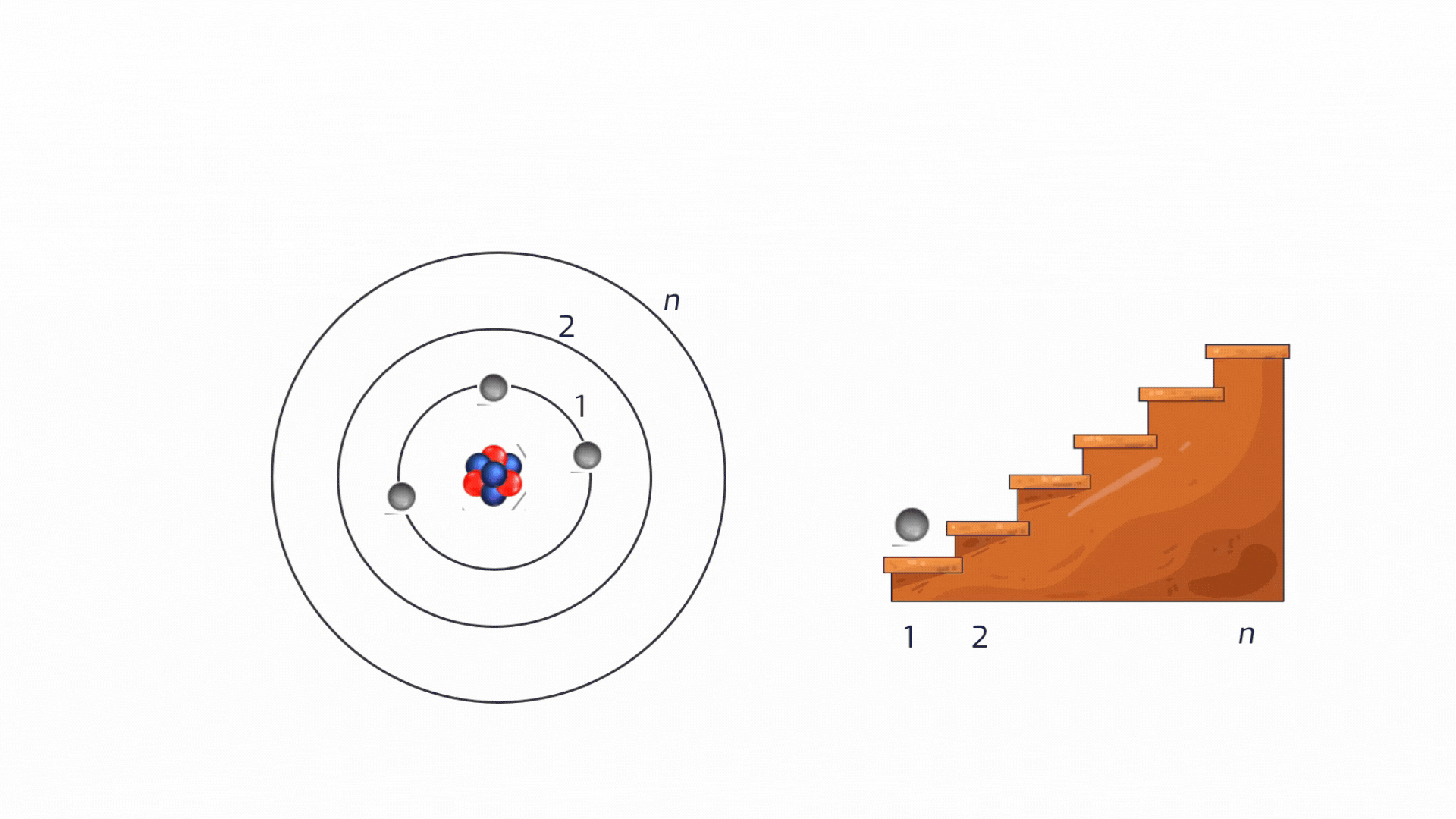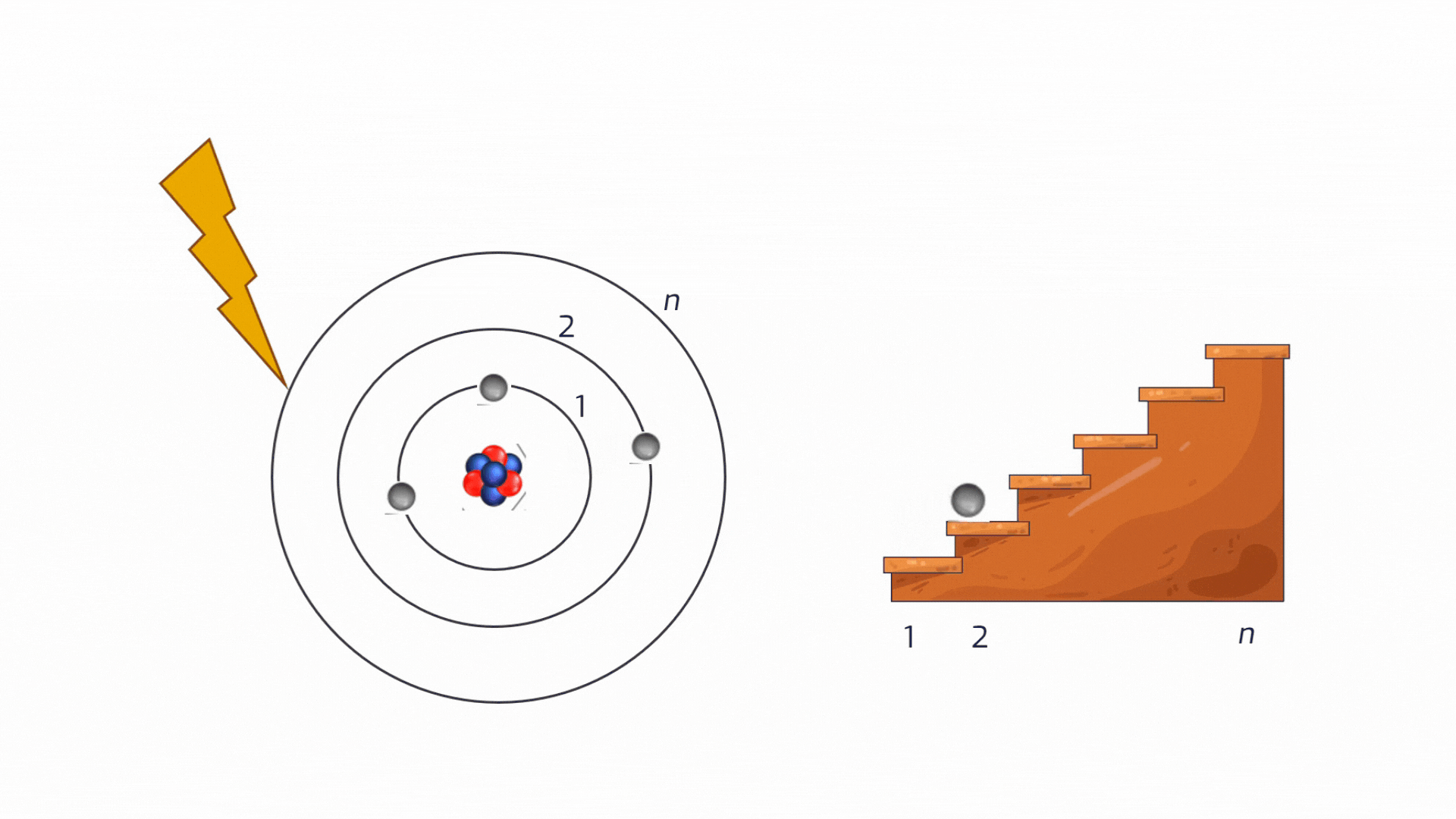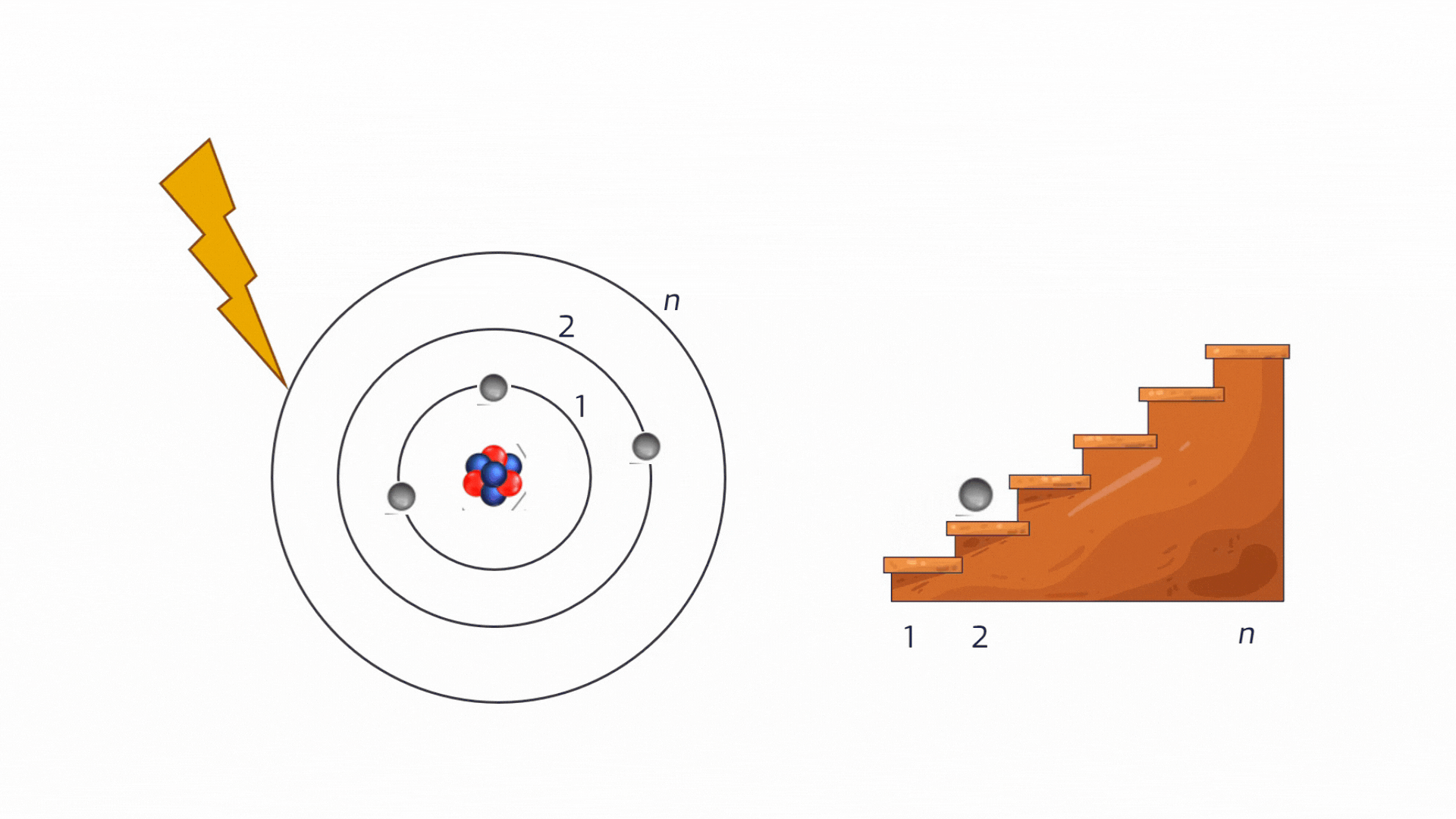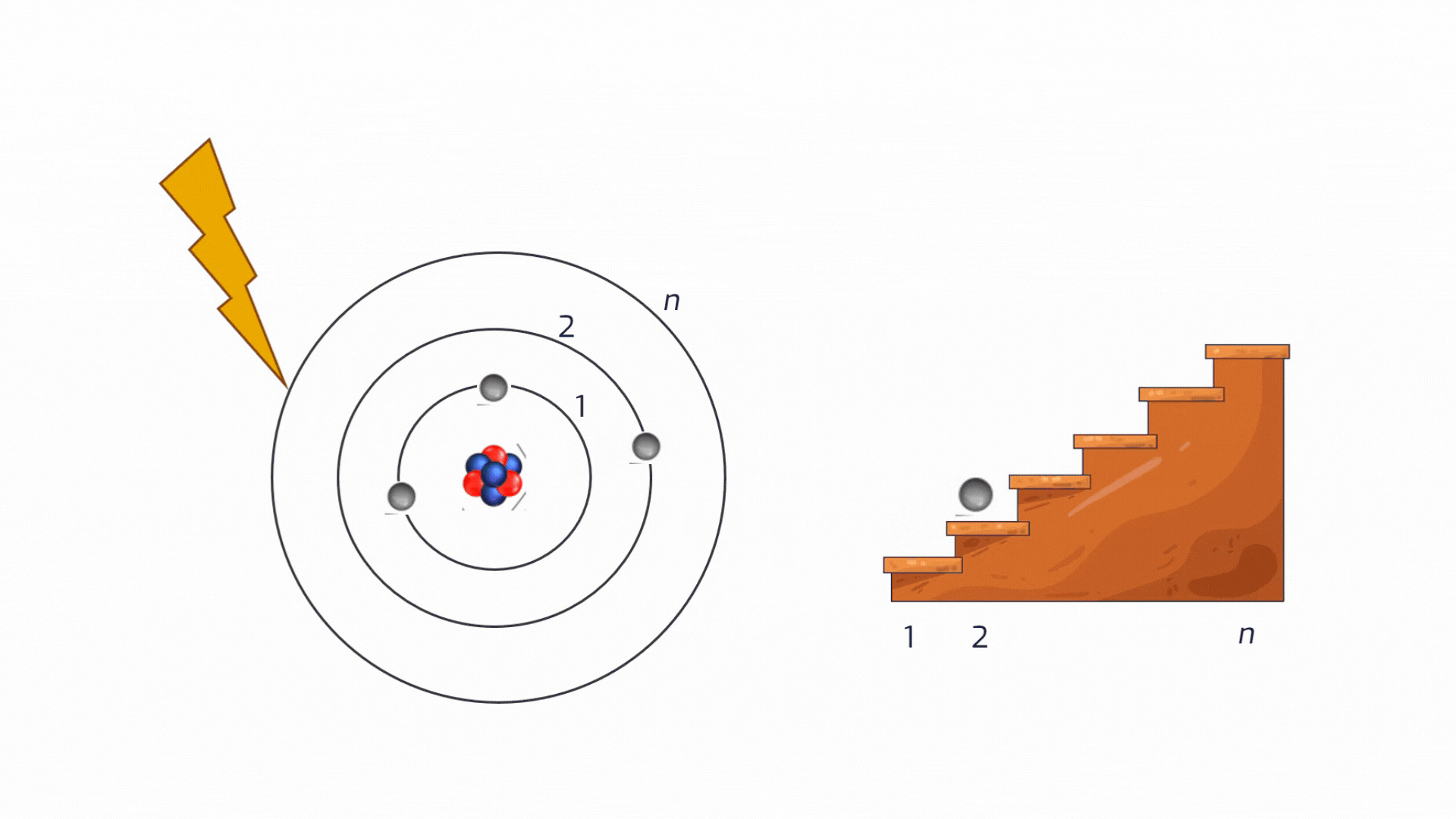
Sebbene l'idea di un'unità indivisibile della materia risalga all'antica Grecia, oggi sappiamo che l'atomo è un mondo complesso in miniatura. Immaginiamolo come un sistema solare microscopico:
-
Nucleo centrale: denso e pesante, composto da protoni e neutroni.
-
Elettroni: attorno al nucleo si muovono gli elettroni, particelle leggerissime con carica elettrica negativa.
La forza elettrica, che fa attrarre le cariche opposte, lega gli elettroni negativi al nucleo positivo, mantenendo l'atomo coeso.
La danza quantistica degli elettroni
La distribuzione degli elettroni intorno al nucleo non è affatto casuale: un elettrone non può orbitare a una distanza qualsiasi dal nucleo. Può occupare solo specifiche "orbite" permesse, che corrispondono a precisi livelli energetici ben individuati (vedremo a breve che i livelli si chiamano quantizzati). Pensiamoli come i gradini di una scala: si può stare su un gradino o su un altro, ma mai a metà.
Il livello di un elettrone può comunque cambiare in seguito a immissione di energia nell'atomo. In tal caso si hanno diversi spostamenti degli elettroni da una orbita (più alta o più bassa) in base all'energia variata nell'atomo (rispettivamente in aggiunta o in diminuzione).
-
Eccitazione: Se forniamo energia a un atomo (ad esempio, scaldandolo), un elettrone può assorbirla e "saltare" a un livello energetico superiore, più lontano dal nucleo. Questo stato è instabile.
 Animazione sul processo di eccitazione di un atomo. Crediti AstronomiAmo
Animazione sul processo di eccitazione di un atomo. Crediti AstronomiAmo
-
Diseccitazione (Emissione): Come appena detto, lo stato eccitato è instabile. L'elettrone tende a tornare spontaneamente a un livello più basso e stabile. Per farlo, deve liberarsi dell'energia in eccesso, che emette sotto forma di un "pacchetto" di luce: un fotone. Il colore della luce emessa dipende esattamente dalla "distanza" tra i due livelli energetici.
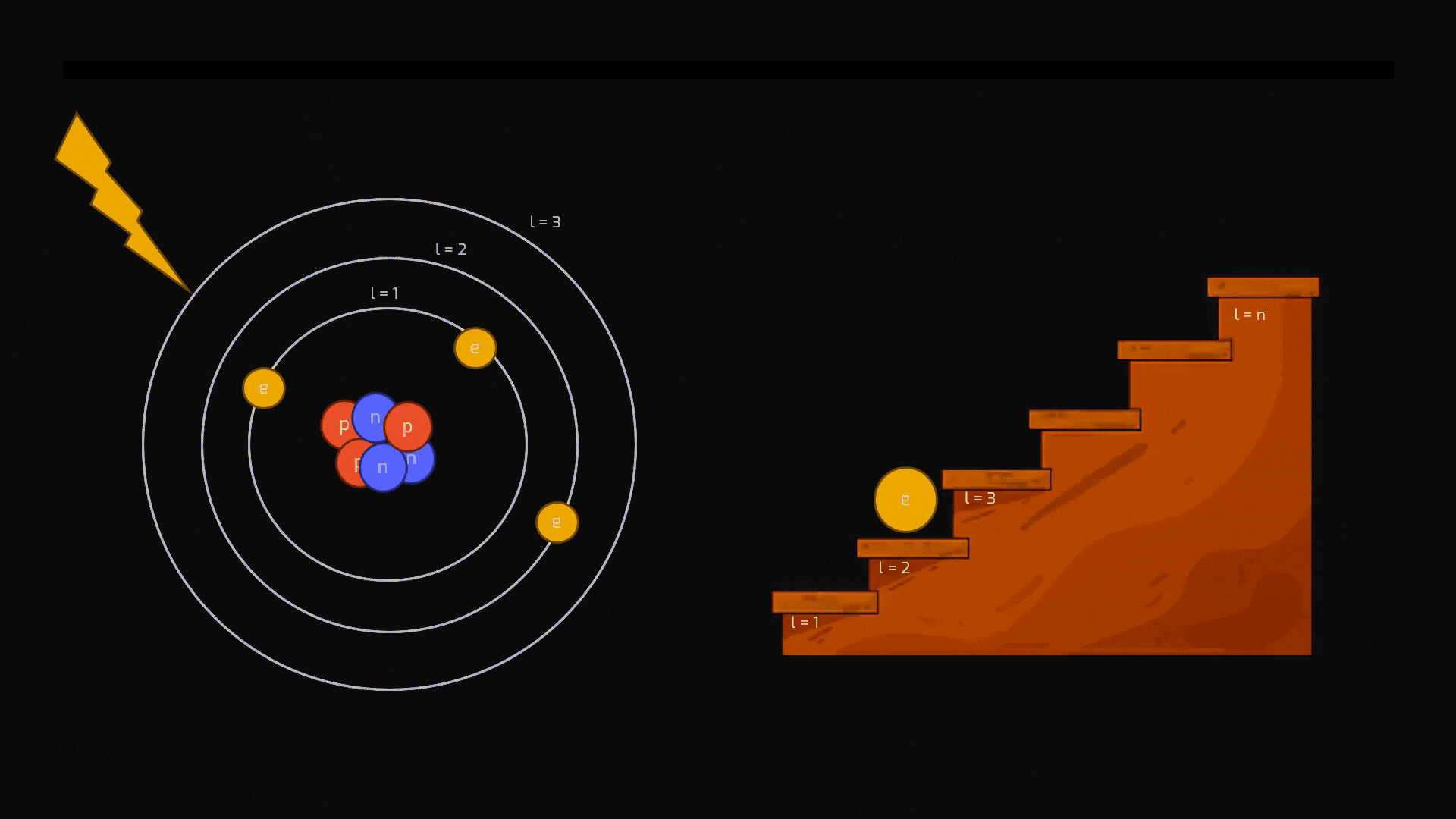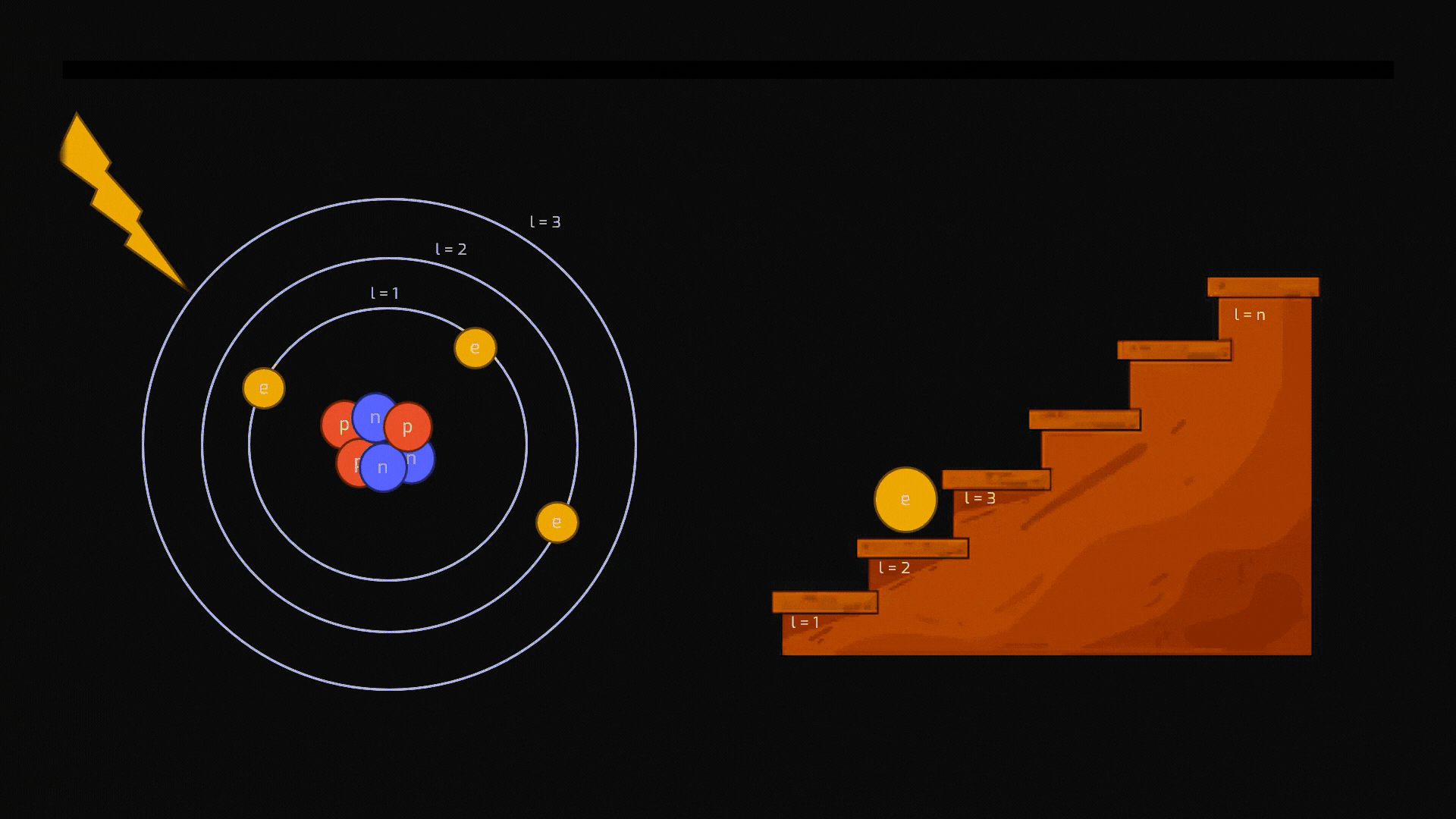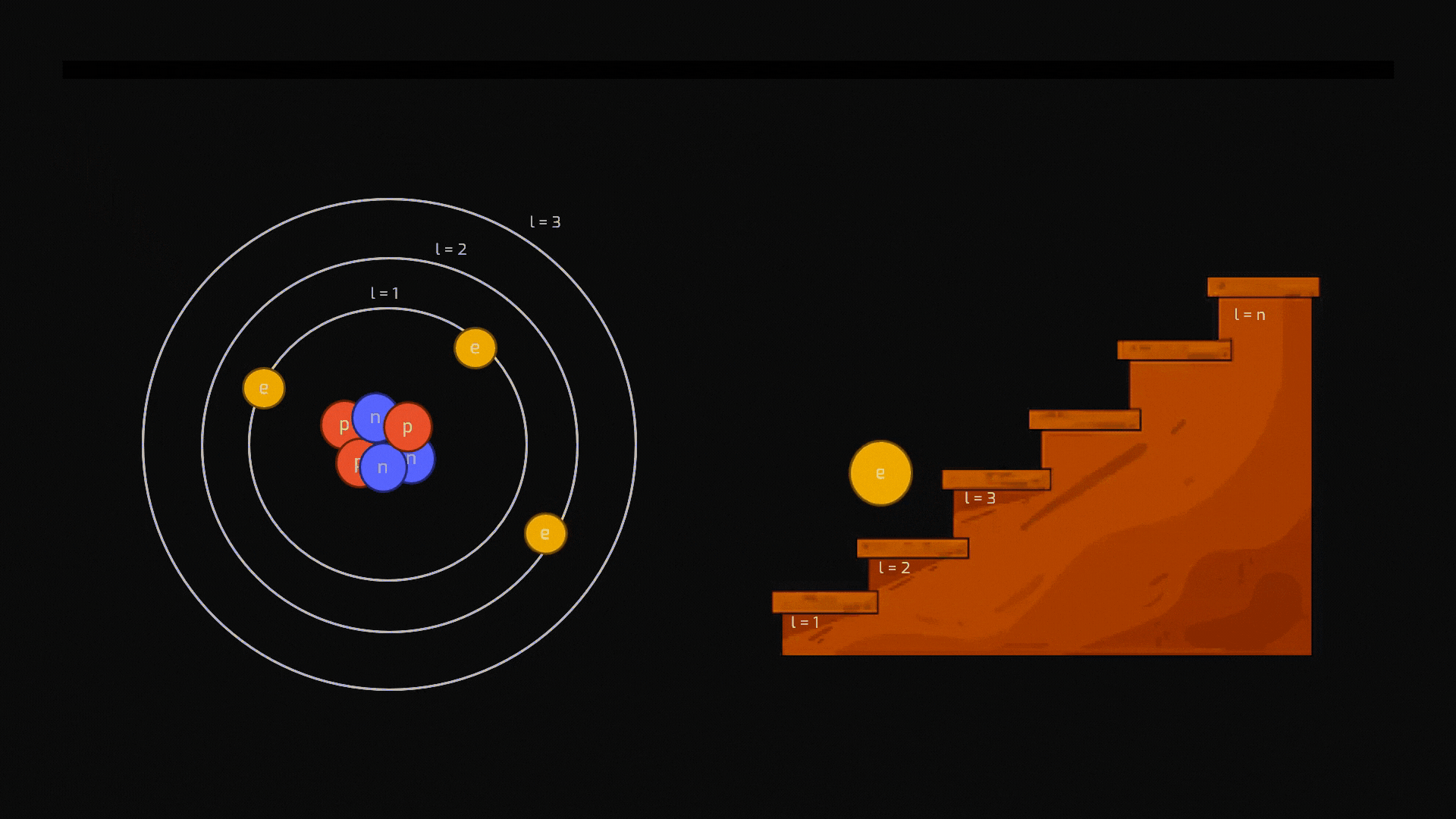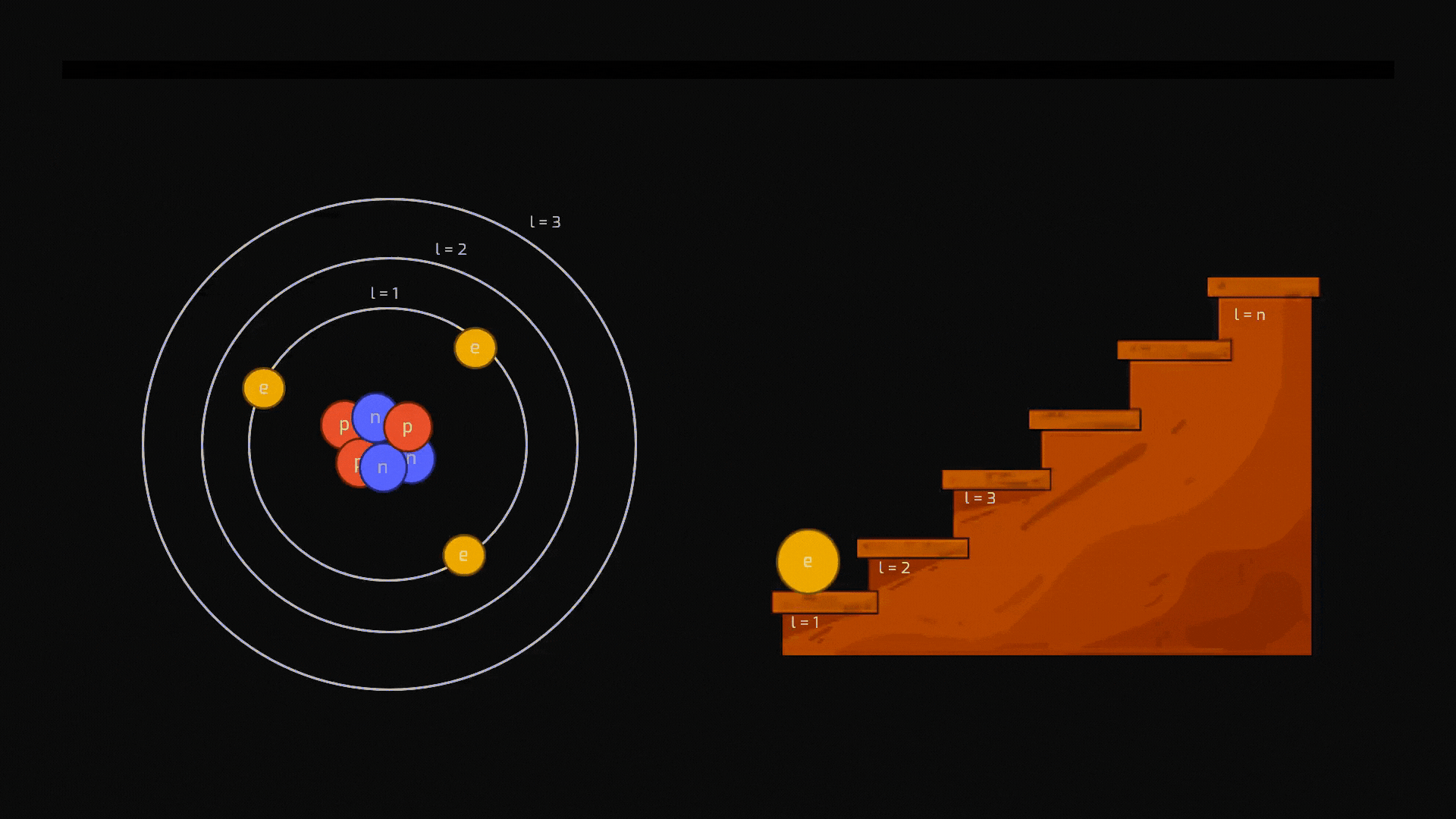 Animazione sul processo di diseccitazione di un atomo. Crediti AstronomiAmo
Animazione sul processo di diseccitazione di un atomo. Crediti AstronomiAmo
-
Ionizzazione: Se l'energia fornita è sufficiente, l'elettrone può essere strappato via dall'atomo, che diventa uno ione. Il processo inverso, la cattura di un elettrone da parte di uno ione, si chiama ricombinazione ed è il fenomeno che produce il rilascio di energia.
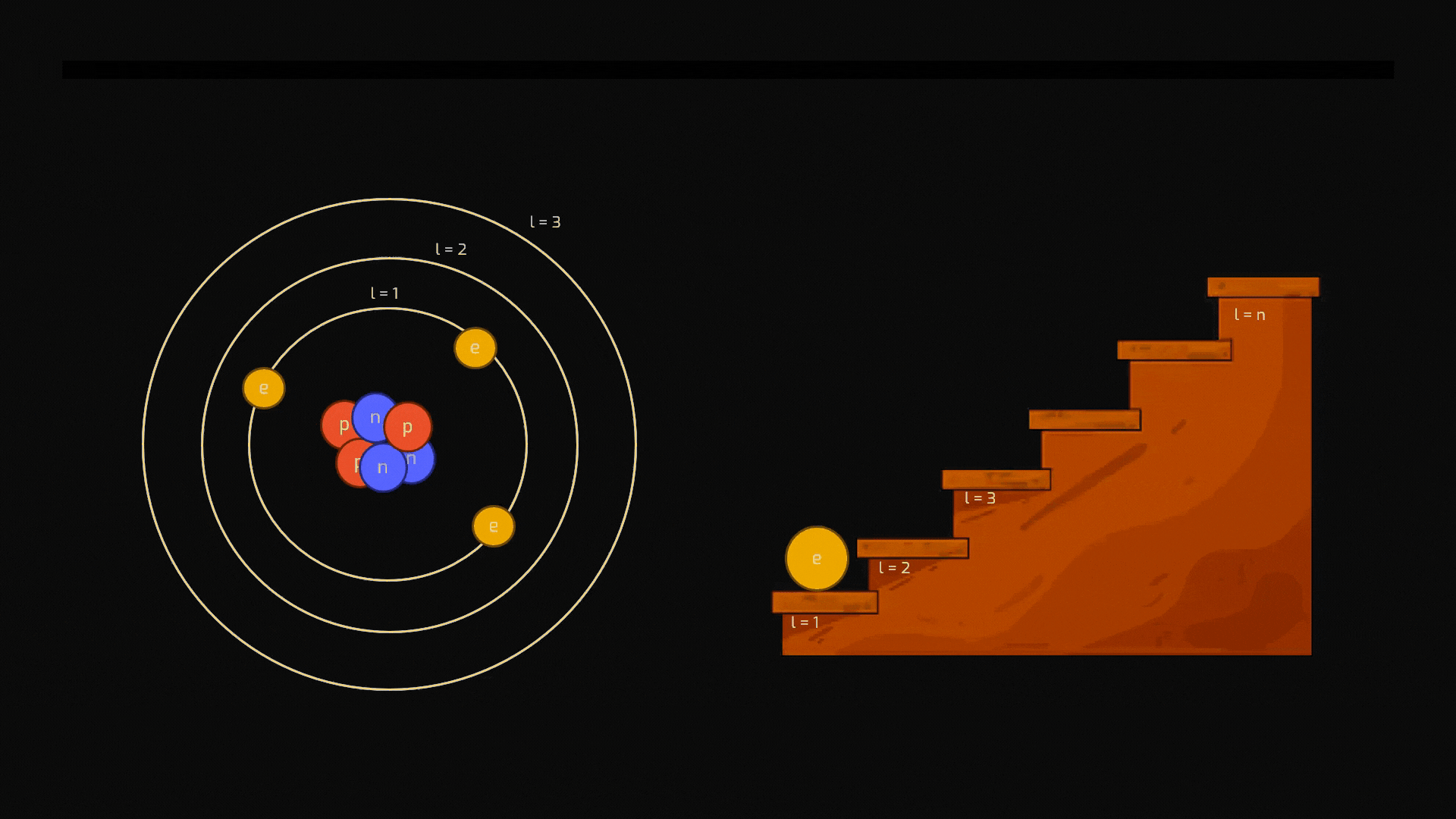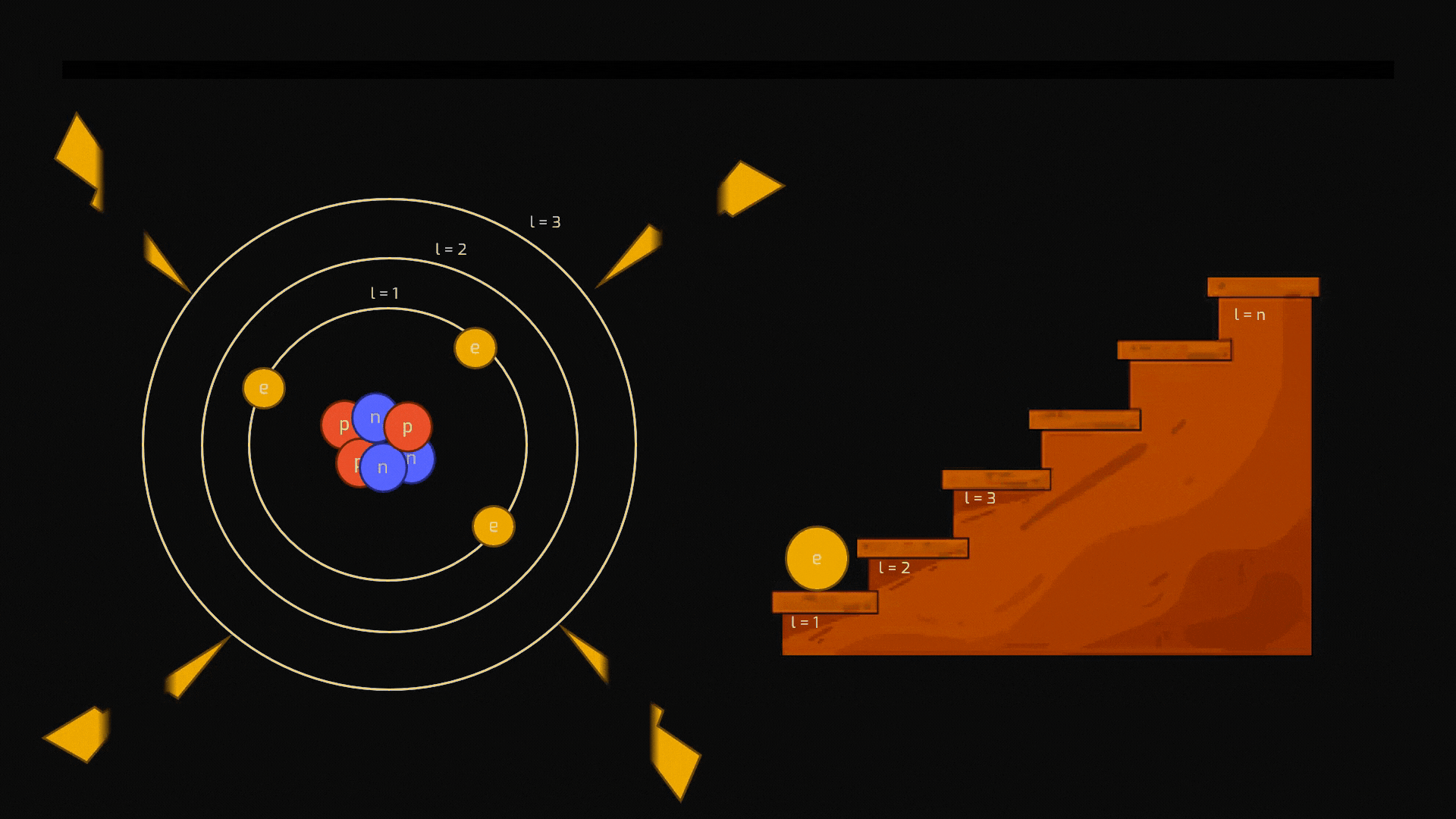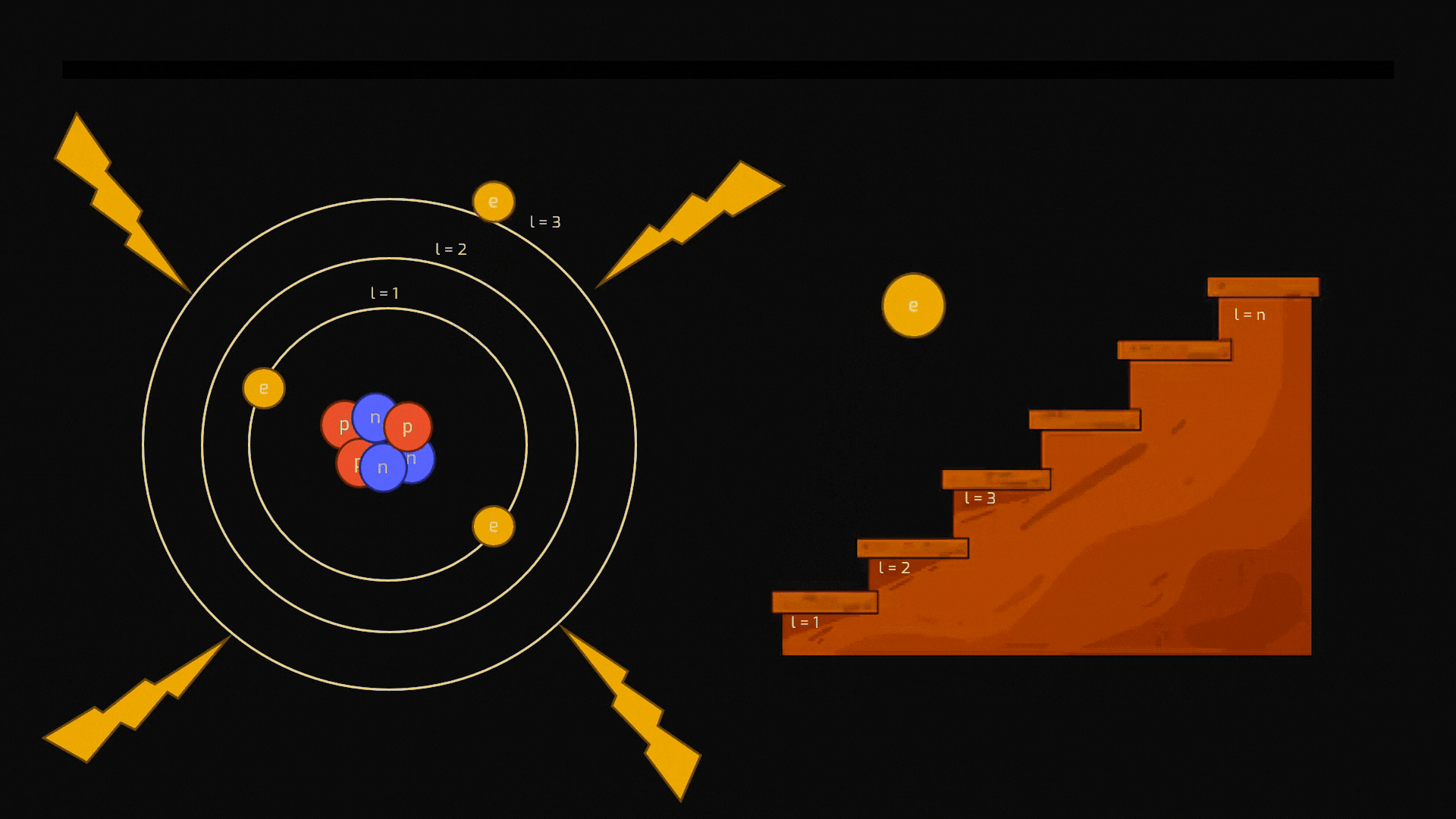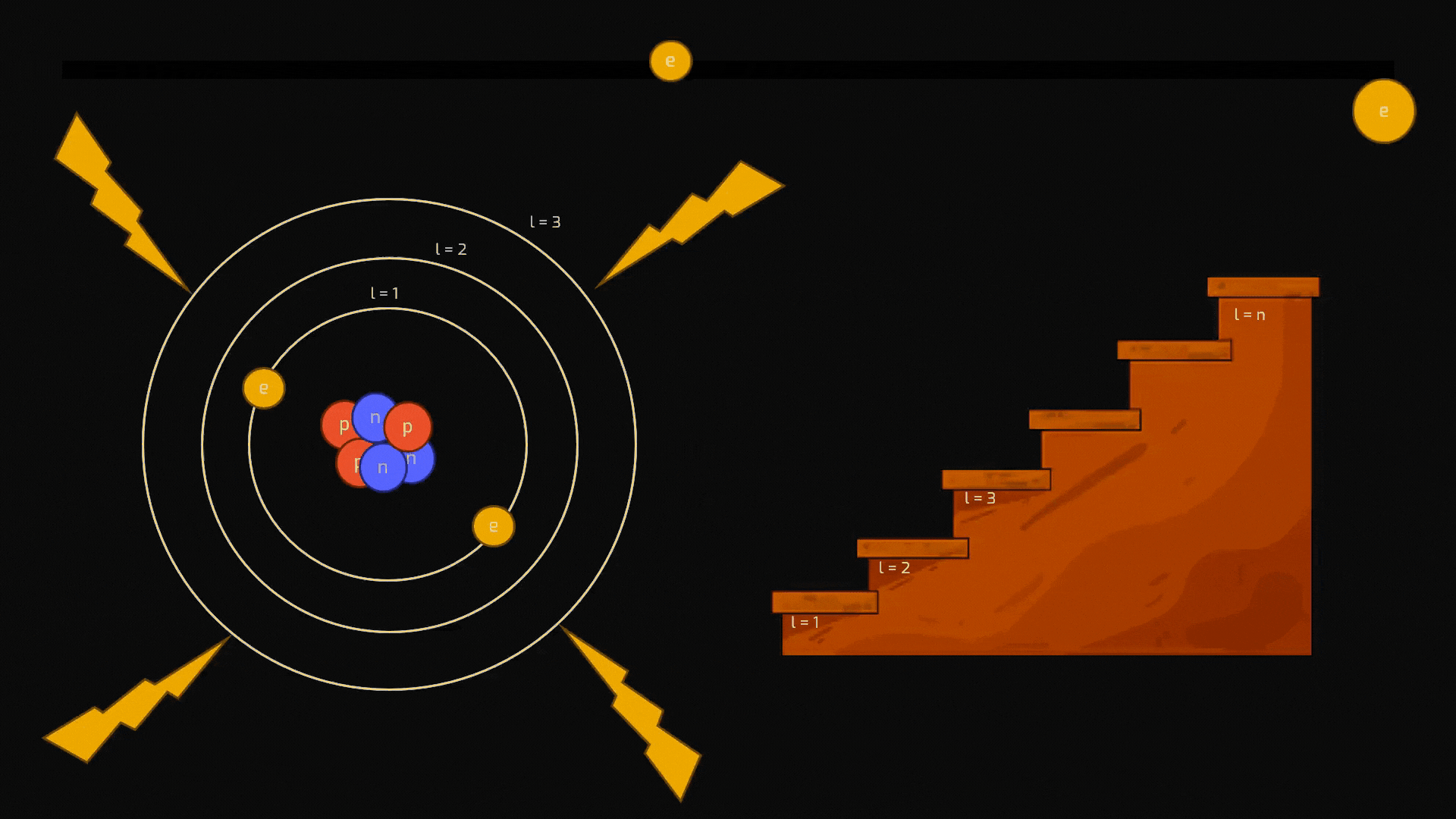 Animazione sul processo di ionizzazionedi un atomo. Crediti AstronomiAmo
Animazione sul processo di ionizzazionedi un atomo. Crediti AstronomiAmo
L'unità di misura più comune per l'energia a livello atomico è l'elettronvolt (eV). 1 eV è l'energia cinetica acquisita da un elettrone accelerato da una differenza di potenziale di 1 Volt.
La differenza tra eccitazione e ionizzazione dipende esclusivamente dalla quantità di energia che viene fornita all'atomo e assorbita da un suo elettrone. Se continuiamo a immaginare i livelli energetici di un elettrone come i gradini di una scala, l'elettrone si trova normalmente sul gradino più basso possibile (stato fondamentale).
L'eccitazione si verifica quando l'elettrone assorbe un "pacchetto" di energia (un fotone) che ha la quantità esatta per permettergli di salire su un gradino più alto, ma non di abbandonare la scala. L'energia fornita è quindi inferiore all'energia necessaria per liberare l'elettrone: l'elettrone si sposta a un livello energetico superiore, ma rimane legato all'atomo. Questo stato è instabile, e l'elettrone tornerà a un livello inferiore, emettendo luce nel processo.
La ionizzazione avviene quando l'elettrone assorbe una quantità di energia uguale o superiore a un valore critico, noto come energia di ionizzazione. Questa energia è sufficiente non solo per salire i gradini, ma per essere "lanciato" completamente fuori dalla scala. L'elettrone abbandona l'atomo, che non è più elettricamente neutro e diventa uno ione con carica positiva. Questa energia di ionizzazione (Ei) è tale per cui:
Efornita ≥ Ei
dove i indica l'energia dell'ultimo livello vincolato al nucleo atomico.
L'atomo più semplice, l'Idrogeno (H), è spesso il punto di riferimento. L'energia del suo (unico) elettrone nello stato fondamentale è circa −13.6 eV: per portarlo a un livello superiore (eccitazione, p. es. n=2), servono 10.2 eV. Per rimuoverlo completamente (ionizzazione), l'energia necessaria è l'opposto dell'energia di legame: 13.6 eV. Significa che se forniamo 12 eV all'Idrogeno, avremo eccitazione. Se forniamo 15 eV, avremo ionizzazione, e l'elettrone fuggirà con 1.4 eV di energia cinetica (15 - 13.6).
Per altri elementi, i valori sono differenti. Ad esempio, per il sodio il primo potenziale di ionizzazione è pari a 5.14 eV, per il cloro è 13.01 eV e per il neon è 21.56 eV.
La luce: dualismo onda-particella
La natura della luce è stata al centro di un affascinante dibattito, sempre sul filo tra onda e particella fino a sposare entrambe le forme
Luce: un'onda o una particella? La storia di un dilemma
Per secoli, la vera natura della luce è stata al centro di un acceso dibattito scientifico.
Newton e la Luce come Corpuscolo
All'inizio del '700, Isaac Newton propose che la luce fosse composta da un flusso di minuscole particelle, o corpuscoli. Questa teoria spiegava bene fenomeni come la riflessione. Con il suo celebre esperimento, dimostrò che un prisma di vetro scompone la luce bianca nei colori dell'arcobaleno, intuendo correttamente che il colore non è una proprietà della luce, ma un'interpretazione del nostro cervello.
La rivincita dell'onda: l'esperimento della doppia fenditura di Young
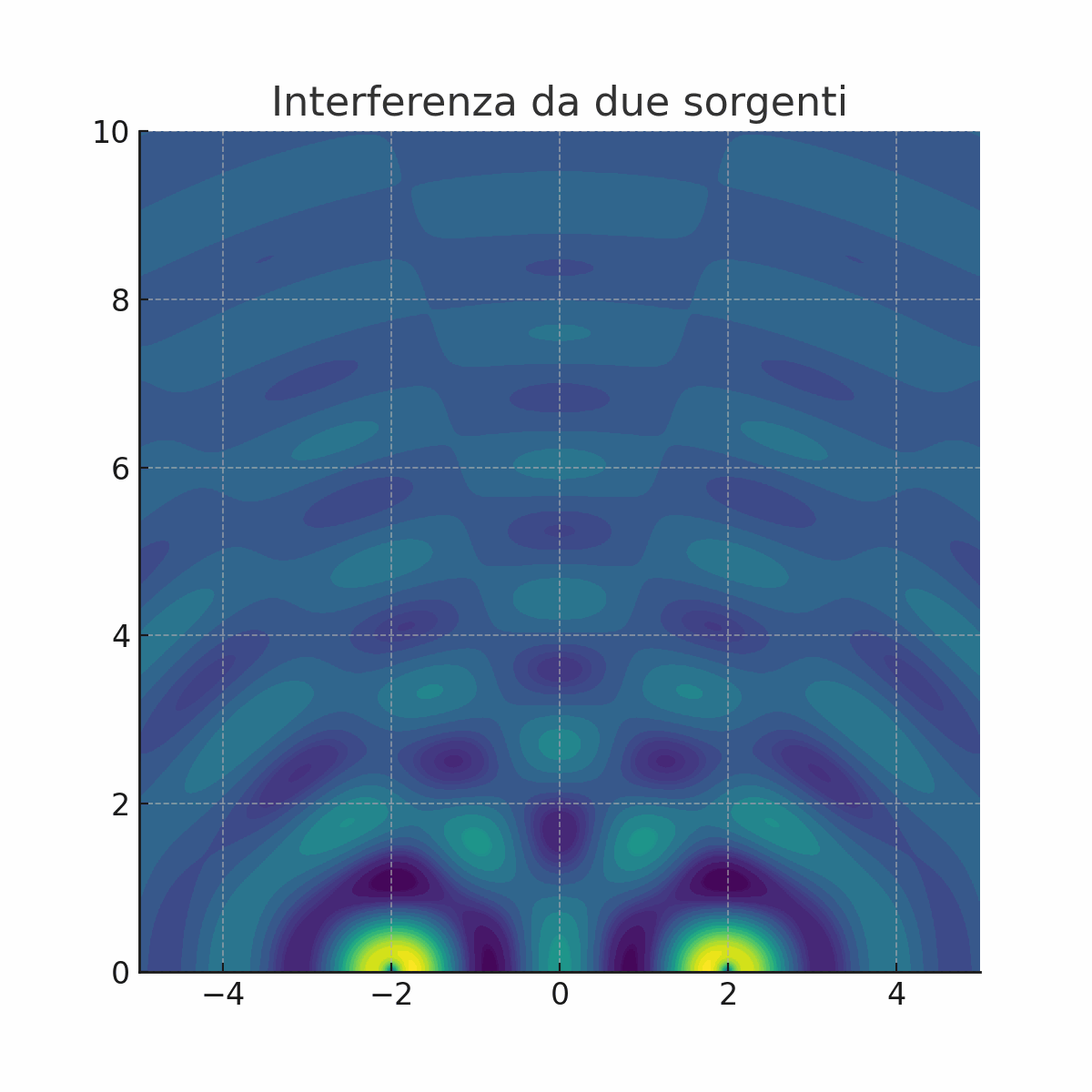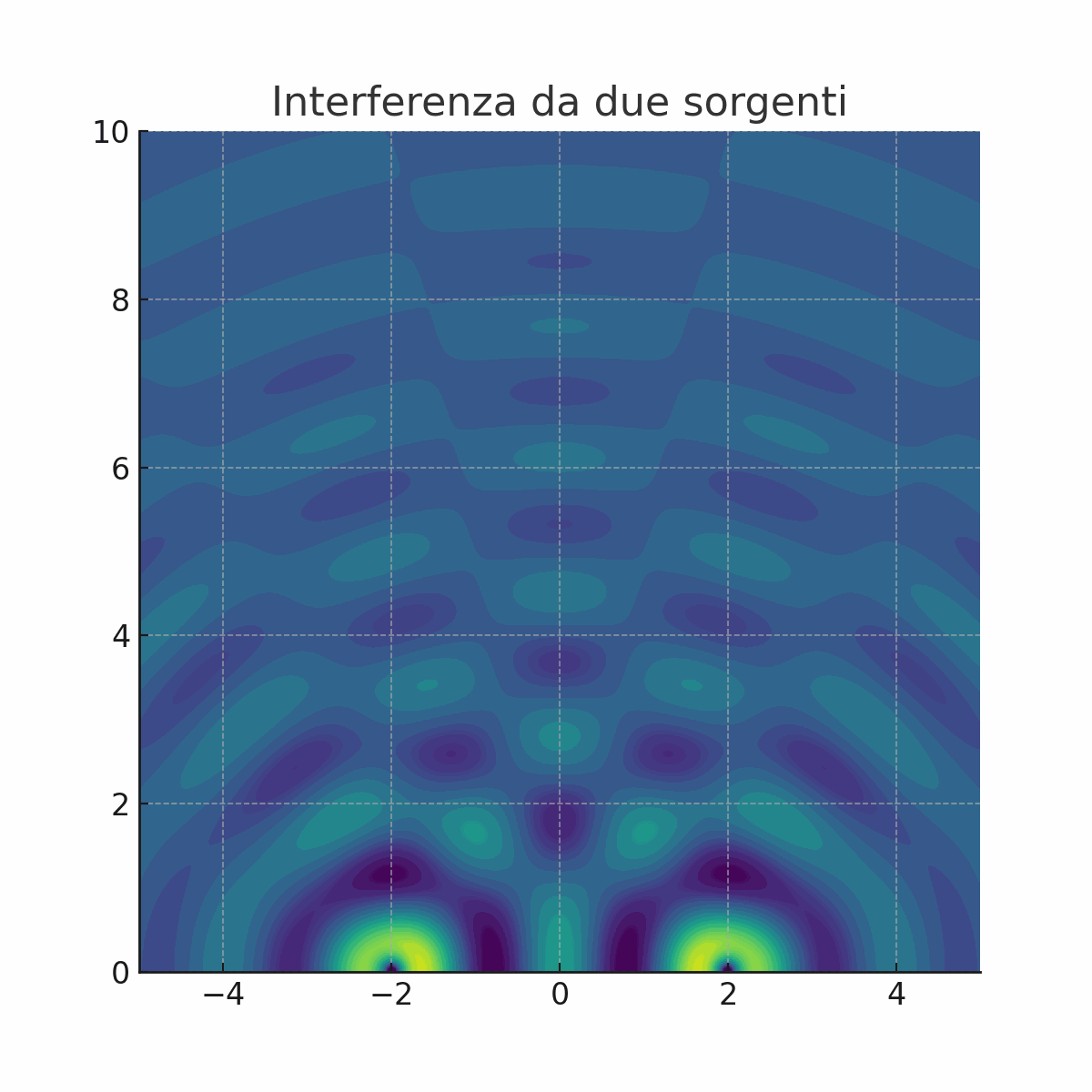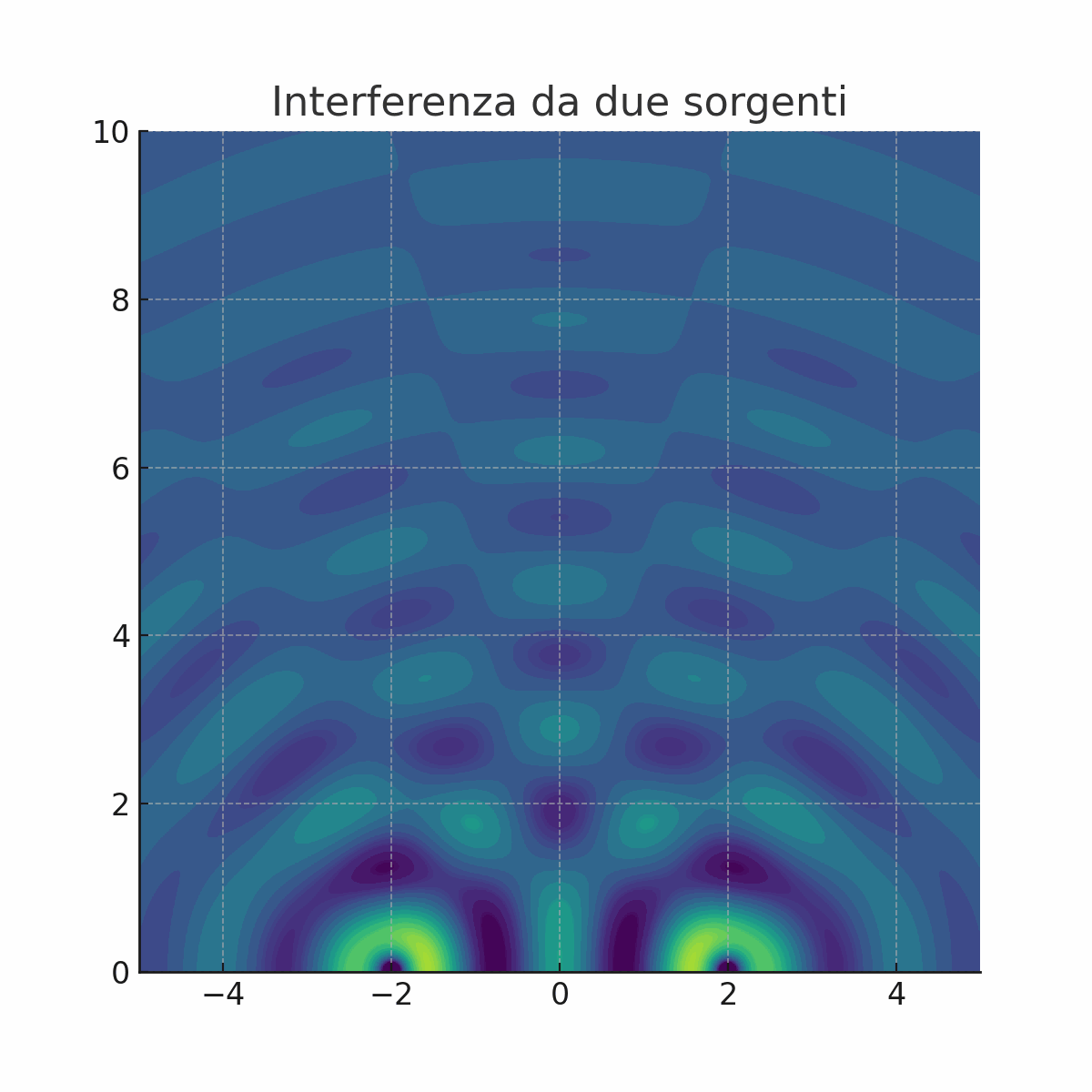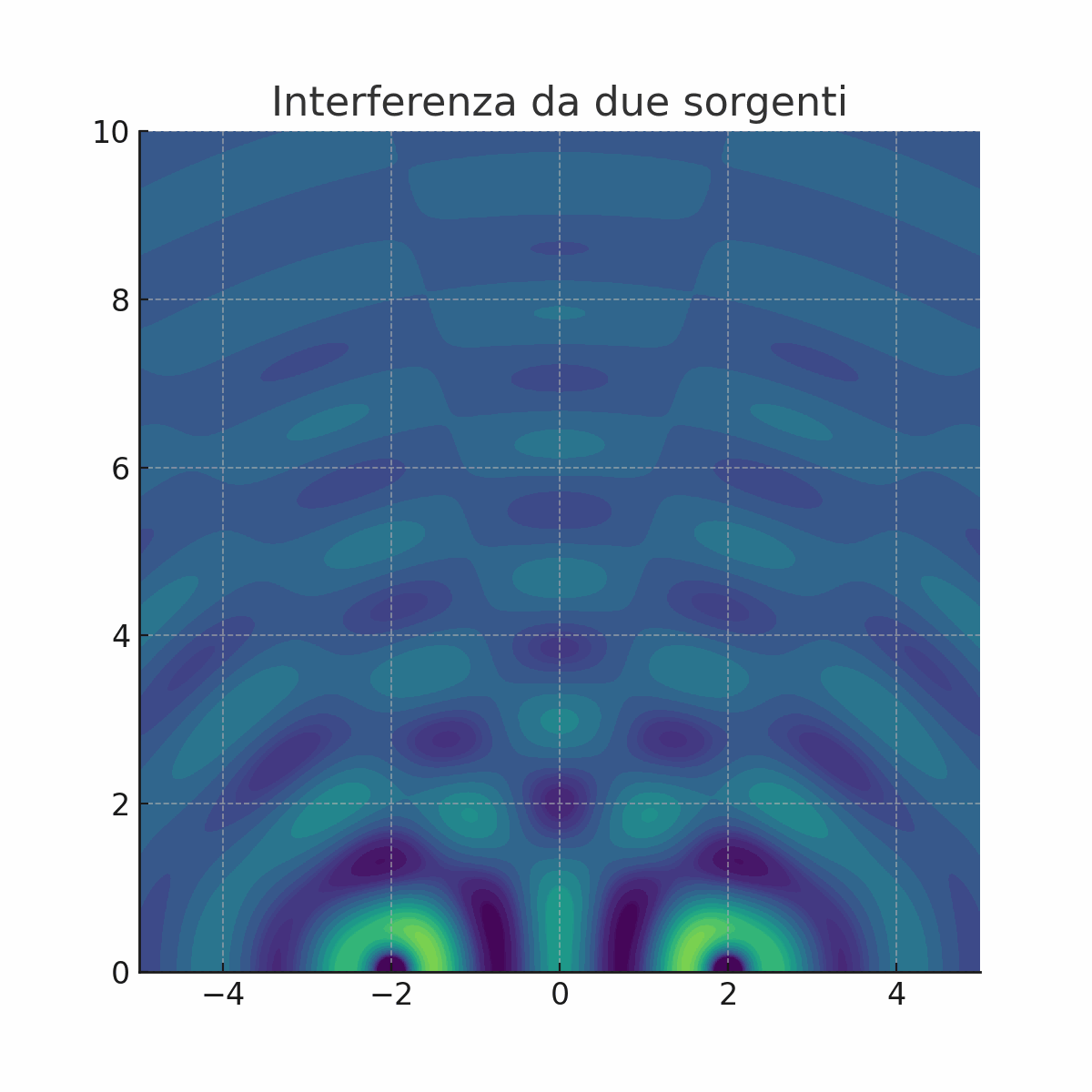 Non tutti erano convinti dalla teoria di Newton. La prova decisiva a favore della natura ondulatoria della luce arrivò nel 1801 con un esperimento tanto semplice quanto geniale, condotto da Thomas Young, il quale proiettò un fascio di luce contro uno schermo che aveva due sottili fessure parallele e molto vicine tra loro.
Non tutti erano convinti dalla teoria di Newton. La prova decisiva a favore della natura ondulatoria della luce arrivò nel 1801 con un esperimento tanto semplice quanto geniale, condotto da Thomas Young, il quale proiettò un fascio di luce contro uno schermo che aveva due sottili fessure parallele e molto vicine tra loro.
Cosa ci si aspettava se la luce fosse fatta di particelle? Immaginiamo di sparare dei proiettili contro le due fessure. Sul muro retrostante, troveremmo semplicemente due strisce di proiettili, una in corrispondenza di ciascuna fessura. Cosa osservò invece Young? Sullo schermo non apparvero due semplici linee luminose, ma una serie di bande chiare e scure alternate. Questa figura, chiamata figura di interferenza, era la prova schiacciante che la luce si comportava come un'onda (animazione a sinistra).
Infatti, quando un'onda attraversa le due fessure, ogni fessura diventa una nuova sorgente di onde circolari, proprio come se gettassimo due sassi in uno stagno. Queste nuove onde si sovrappongono e "interferiscono" tra loro.
-
Dove le creste di due onde si sommano, l'onda si rafforza (interferenza costruttiva), creando una banda luminosa.
-
Dove la cresta di un'onda incontra il ventre di un'altra, le due si annullano (interferenza distruttiva), creando una banda scura.
Questo esperimento dimostrò in modo inconfutabile la natura ondulatoria della luce. Anni dopo, le equazioni di James Clerk Maxwell unificarono elettricità e magnetismo, definendo la luce come un'onda elettromagnetica che si propaga alla velocità costante di circa 300.000 km/s.
La crisi della fisica classica e l'avvento dei quanti
La fisica si è completata quando la natura della luce è stata perfettamente individuata: sia onda sia particella
Alla fine del XIX secolo, la fisica sembrava completa. Tuttavia, un problema noto come radiazione di corpo nero stava per far crollare tutto l'edificio.
Il problema era che, secondo le leggi classiche di Maxwell, un corpo nero caldo avrebbe dovuto emettere una quantità infinita di energia sotto forma di luce ultravioletta. Questo paradosso, palesemente errato, fu chiamato "catastrofe ultravioletta".
Alla fine del XIX secolo, i fisici Lord Rayleigh e Sir James Jeans cercarono di spiegare la distribuzione dell'energia radiante di un corpo nero usando le leggi della termodinamica e dell'elettromagnetismo classici. La loro derivazione, nota come Legge di Rayleigh-Jeans, è data dalla formula:
I(λ,T) = (2ckBT) / λ4
Dove:
-
I(λ,T) è l'intensità (o energia) della radiazione emessa per una data lunghezza d'onda (λ) e temperatura (T).
-
c è la velocità della luce.
-
kB è la costante di Boltzmann.
-
λ è la lunghezza d'onda.
-
T è la temperatura assoluta.
Il problema: Il crollo alle brevi lunghezze d'onda
La formula di Rayleigh-Jeans funzionava bene per le lunghezze d'onda lunghe (come le onde radio o l'infrarosso), ma falliva drasticamente per le lunghezze d'onda corte (come il blu, l'ultravioletto e i raggi X). Osserva la formula: man mano che la lunghezza d'onda (λ) si avvicina a zero (ovvero, ci muoviamo verso l'ultravioletto e oltre), il termine (1 / λ4) tende all'infinito.
Questo risultato implicava che un corpo nero dovesse emettere una quantità infinita di energia alle brevi lunghezze d'onda (ultravioletto e oltre). Ciò non solo contraddiceva le osservazioni sperimentali (i corpi neri emettono intensità che poi scendono a zero anche nell'ultravioletto), ma violava anche il principio di conservazione dell'energia.
Questo fallimento, in cui l'energia "esplode" nell'estremità ultravioletta dello spettro, fu sarcasticamente chiamato la "catastrofe ultravioletta".
La soluzione arrivò da due rivoluzioni del pensiero:
-
Max Planck (1900): Per risolvere il problema, Planck avanzò un'ipotesi radicale: l'energia non viene scambiata in modo continuo, ma in pacchetti discreti e indivisibili, che chiamò quanti. L'energia di un singolo quanto è proporzionale alla sua frequenza (E = hf, dove h è la costante di Planck). La formula di Planck, che risolve la catastrofe ultravioletta, è: $$B(\lambda, T) = \frac{2hc^2}{\lambda^5} \frac{1}{e^{\frac{hc}{\lambda k_B T}} - 1}$$ dove il termine esponenziale garantisce che la curva decada rapidamente a frequenze molto alte.
-
Albert Einstein (1905): Einstein portò l'idea di Planck alle sue estreme conseguenze, proponendo che la luce stessa fosse fatta di questi quanti di energia, che oggi chiamiamo fotoni. Spiegò l'effetto fotoelettrico, un fenomeno per cui la luce, colpendo una superficie metallica, può espellere elettroni. Einstein dimostrò che l'espulsione non dipende dall'intensità della luce, ma dalla sua frequenza. Serve un singolo fotone con l'energia giusta per "scalzare" un elettrone. Questo dimostrava che la luce, nell'interazione con la materia, si comporta come una particella.
Chi aveva ragione, quindi? Newton con le sue particelle o Young con le sue onde? Entrambi. La luce possiede una sorprendente duplice natura (dualismo onda-particella): si propaga nello spazio come un'onda, ma scambia energia con la materia come se fosse una particella.
La luce che i nostri occhi possono vedere è solo una piccolissima parte di tutto lo spettro elettromagnetico. Tutte le onde elettromagnetiche sono della stessa natura, ma si differenziano per la loro energia (e quindi per la loro frequenza e lunghezza d'onda). Ordinandole per energia crescente, abbiamo: onde radio, microonde, infrarosso, luce visibile, ultravioletto, raggi X e raggi gamma.
Ogni porzione di questo spettro ci svela dettagli diversi e complementari sull'universo. Solo osservando un oggetto celeste in tutte le lunghezze d'onda possiamo sperare di decifrare completamente i messaggi che il suo fotone ha trasportato per noi attraverso il cosmo.
Post più popolari

K2-18b: Tra speranza e scetticismo
22/04/2025

Stella polare: cosa è e come trovarla
08/11/2024

 Chi Siamo
Chi Siamo Terra in Vista 2024
Terra in Vista 2024 Relatori
Relatori Argomenti
Argomenti WebTV
WebTV Sole
Sole Luna
Luna Strutture lunari
Strutture lunari Mercurio
Mercurio Venere
Venere Marte
Marte Giove
Giove Satelliti di Giove
Satelliti di Giove Saturno
Saturno Urano
Urano Nettuno
Nettuno Asteroidi
Asteroidi Comete
Comete Bolidi
Bolidi Sciami meteorici
Sciami meteorici ISS
ISS Altri satelliti
Altri satelliti Lanci
Lanci Costellazioni
Costellazioni Stelle
Stelle Profondo cielo
Profondo cielo Esopianeti
Esopianeti Cielo del mese
Cielo del mese Eclissi di Sole
Eclissi di Sole Eclissi di Luna
Eclissi di Luna